Laia Toll Salillas. Graduada en Veterinaria.
El procesado rutinario de las muestras histológicas consta de las siguientes fases:
1. Recogida de la muestra.
2. Fijación.
3. Recepción y registro de la muestra.
4. Descripción macroscópica y corte.
5. Inclusión de la muestra.
6. Confección de los bloques.
7. Corte histológico – Microtomía.
8. Tinción de los cortes.
9. Montaje de la preparación histológica.
10. Observación al microscopio y diagnóstico.
1. Recogida de la muestra
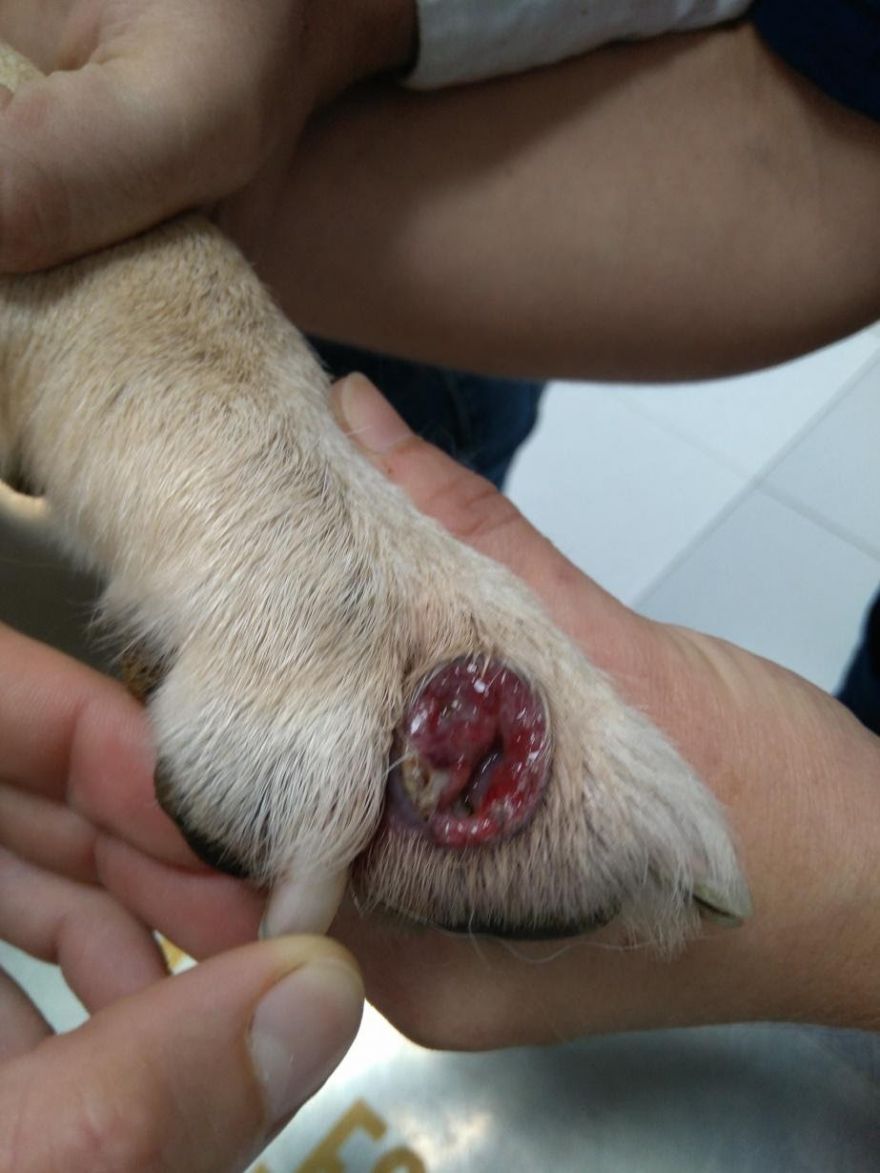
Recogida del tejido de interés del paciente para su estudio, ya sea una biopsia en la que obtenemos la muestra de un individuo vivo, o un estudio histopatológico donde se realiza un muestreo de varios o todos los órganos después de una necropsia previa.
2. Fijación
Consiste en interrumpir los procesos de autolisis y putrefacción que aparecen tras la muerte celular, tratando de conservar la arquitectura y composición tisular lo más próxima posible a como se encontraba en el organismo vivo dando una imagen estática del tejido. Por ello, para evitar estos procesos, el tejido debe ser colocado inmediatamente en el líquido fijador tras su extracción. Asimismo aumenta la consistencia del tejido lo que facilita el corte, mejora la captación de los colorantes (efecto mordiente) y tiene acción antiséptica. Hay diferentes agentes fijadores pero el más comúnmente utilizado para el procesado histológico es el formaldehído al 4 % (también conocido como formol), que es un tipo de fijador químico que funciona por inmersión de la muestra en la solución fijadora.
La velocidad de fijación de la muestra va a depender del tamaño de la muestra y del tipo de tejido.
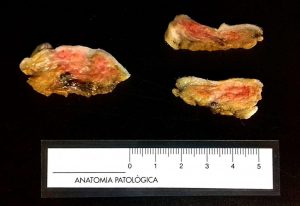
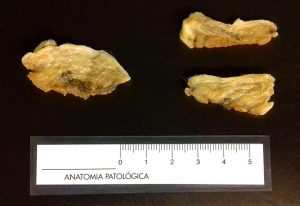
Fig. 1 y 2: Tres fragmentos de una cadena mamaria de una perra. La imagen de la izquierda presenta unas áreas rosáceas lo que indica que todavía está cruda y ha de permanecer más tiempo en la solución fijadora. La imagen de la derecha ya está bien fijada y puede procederse a hacerse la descripción macroscópica y el corte.
3. Recepción y registro de la muestra
Cuando llega la muestra, se le asigna un número interno del laboratorio y se registra.
4. Descripción macroscópica y corte
El examen macroscópico comienza con la observación y caracterización de los hallazgos anormales. Se describe exactamente el tipo de material remitido para su estudio, incluyendo sus dimensiones y las lesiones que contiene, así como se especifica su morfología, aspecto, coloración. A continuación, se seleccionan las zonas más significativas de las lesiones halladas sobre las que va a realizarse el estudio microscópico y se realiza el corte en pequeñas porciones (no deben superar los 3 -5 mm de espesor) para posteriormente introducirlo dentro de una casete de plástico y cerrarlo.

Fig. 3: Fragmento de cadena mamaria
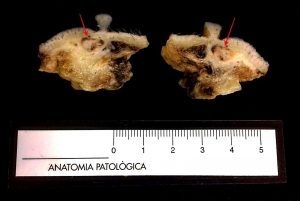
Fig. 4: Corte sagital de un fragmento de cadena mamaria en el que se observa un pequeño nódulo blanco – parduzco, firme, bien delimitado (flechas rojas).
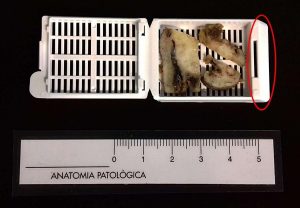
Fig. 5: El fragmento de cadena mamaria es cortado en porciones más pequeñas para su procesado. Se realizan 3 orientaciones para valorar todos los márgenes. En el círculo rojo es donde va el número de identificación del paciente.
La descripción macroscópica es tan importante como la microscópica porque las lesiones macroscópicas de algunas enfermedades son suficientemente distintas en su comportamiento que permiten su diagnóstico presuntivo basado sólo en su observación directa.

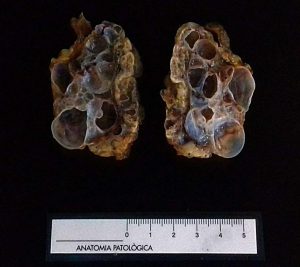
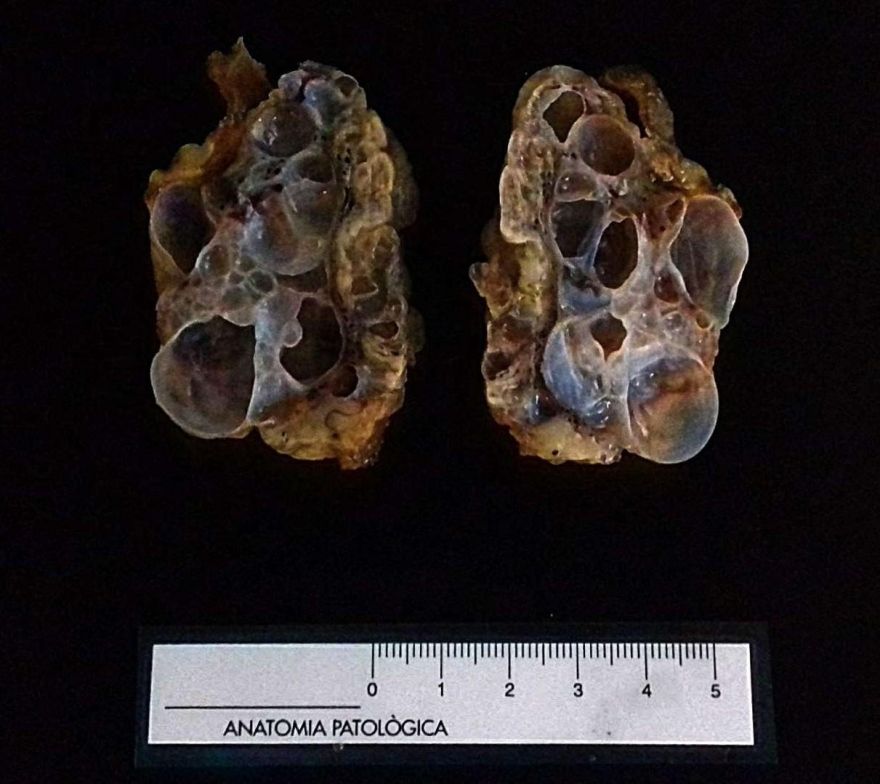
Fig.6 y 7: Macroscopía de un ovario con múltiples quistes superficiales altamente compatible con una poliquistosis ovárica a la espera de confirmación histológica.
5. Inclusión
Consiste en dar dureza homogénea al tejido para poder ser cortado posteriormente a una medida de micras mediante el microtomo y poder ser observado en el microscopio. Esta dureza se consigue mediante la inclusión en un medio sólido, como la parafina, que es una sustancia cérea que a temperatura ambiente es sólida.
Hay que tener en cuenta que la parafina es hidrófoba, por lo tanto no se va a mezclar bien con el agua que hay en el tejido ni con el formol (que es una solución acuosa), y hay que eliminarla. Para conseguirlo se realiza una deshidratación mediante una serie de alcoholes de gradación creciente (50°C, 70°C, 80°C, 95°C y alcohol absoluto) y un posterior aclaramiento, en el que sustituimos el agente deshidratante por una sustancia miscible con la parafina, como es el xileno. A continuación ya se puede proceder a la infiltración en parafina de la muestra histopatológica. Todo este proceso se realiza en el procesador automático de tejidos y tiene una duración aproximada de 12 horas.

Fig. 8: Procesador automático de tejidos.
6. Confección de bloques
Consiste en la obtención de un bloque sólido con la muestra histopatológica. Para obtenerlo se utiliza un molde previamente rellenado con parafina líquida donde se coloca el tejido de estudio y se cierra con una de las partes del casete para que el bloque tenga un soporte cuando se saque el molde. A continuación se pone en una superficie fría a 4 °C para que el molde se solidifique y ya poder proceder al corte. Es importante colocar la muestra en la orientación adecuada al tipo de corte que se desea realizar. El tiempo de elaboración de los bloques va a depender del número de casetes que se hayan preparado durante el examen macroscópico.

Fig. 9: Tejido infiltrado con parafina una vez finalizado el proceso de inclusión.

Fig. 10: Tejido en el molde con parafina líquida.

Fig. 11: Bloques preparados en la placa fría para que se solidifiquen.

Fig. 12: Bloques preparados para cortar.
7. Corte histológico – Microtomía
La microtomía es la técnica mediante la cual se consiguen cortes con medida de micras utilizando un microtomo. Una vez realizado el corte se coloca en el baño de flotación (35 – 45 °C) y se coge con el portaobjetos. El tiempo de la realización de los cortes va a depender del número de bloques que haya.



Fig. 13, 14 y 15: Corte del bloque con el microtomo. Los cortes se colocan en el baño de flotación y se recogen con el portaobjetos.
8. Tinción de los cortes histológicos:
La tinción es un proceso por el cual se ponen en evidencia las estructuras celulares y tisulares mediante el uso de colorantes. Su fundamento radica en la propiedad que poseen todos los tejidos para incorporar y fijar sustancias colorantes determinadas. Como la mayoría de ellos son acuosos es necesario sacar la parafina de la muestra para que pueda entrar el colorante; para ello se ponen los portaobjetos con la muestra en una estufa a 60 °C para que la parafina se derrita, y a continuación se colocan las muestras en una serie de alcoholes de gradiente decreciente para volver a rehidratar las muestras y puedan ser teñidas con los colorantes hidrosolubles. Este proceso dura aproximadamente 45 minutos.

Fig. 16: Teñidor automático
Hay muchos tipos de tinciones pero la que se utiliza de forma rutinaria es la Hematoxilina – Eosina (H & E) porque da una visión en conjunto de las estructuras de un tejido o de la arquitectura de una lesión. Se basa en la afinidad ácido-base de los colorantes con las diferentes estructuras celulares y está constituida por dos colorantes:
- Hematoxilina: es un colorante básico que reacciona con las estructuras de carácter ácido, como por ejemplo los núcleos tiñéndolos de azul purpúreo a negro.
- Eosina es un colorante ácido que reacciona con las estructuras de carácter básico, como por ejemplo el citoplasma y lo tiñe de rosado a rojo.
9. Montaje
El proceso de montaje tiene como finalidad que las muestras que han sido teñidas puedan ser observadas de manera óptima al microscopio y puedan mantenerse en excelentes condiciones de conservación. Esto se consigue mediante el medio de montaje, que son resinas sintéticas que ponemos entre el portaobjetos y el cubreobjetos. Este no es miscible en agua con lo que es necesario volver a deshidratar los tejidos (mediante la serie de alcoholes de graduación creciente) y un posterior aclarado con xileno, para poder colocar el medio de montaje, el cubreobjetos y finalmente poder hacer la observación al microscopio.
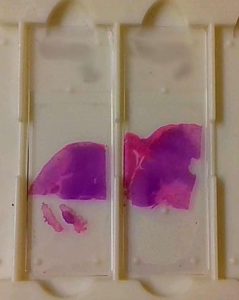
Fig. 17: Preparaciones histológicas teñidas y montadas preparadas para observar al microscopio.
Fig. 18: Microscopio con preparación histológica.
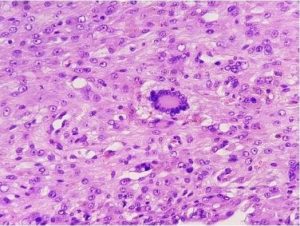
Fig. 19: Observación microscópica de un corte histológico.
Bibliografia:
- Bermejo M.ª José. Técnico especialista en Anatomía Patológica del Servicio Gallego de Salud. Volumen 2. 1ª Edición. España: Editorial MAD S.L.; 2006.
- García del Moral R. Laboratorio de anatomía patológica. 1ª edición. Madrid: S.A. McGraw- Hill / Interamericana de España; 1993
Escrito por: Elisa Ruiz