Melanomas
El melanocito normal es una célula derivada del neuroectodermo. Se localiza en la capa basal de la epidermis, alojado entre queratinocitos, con los cuales establece contactos a través de uniones reguladoras mediadas por moléculas de E-cadherina. La melanina sintetizada por estas células no se almacena en ellas, sino que a través de los procesos dendríticos se traspasa a los queratinocitos.
La conversión de melanocito normal a melanocito neoplásico es un fenómeno que requiere varios pasos: iniciación, promoción, transformación y metástasis.
- a) Iniciación: es poco lo que se sabe de este paso en los melanomas animales. La radiación solar ultravioleta es un conocido iniciador de mutaciones en el DNA melanocítico y responsable de aproximadamente el 65% de los melanomas cutáneos humanos.
En personas, la iniciación a partir de lesiones benignas pigmentadas (nevusidisplásico, nevus melanocítico congénito gigante) contribuye a un pequeño porcentaje de lesiones malignas. En animales, la transformación de un proceso benigno en maligno parece ser un hecho excepcional [1]. - b) Promoción: los factores promotores probablemente actúan sobre varios frentes, facilitando la disrupción de las uniones intercelulares, estimulando la proliferación de la célula mutada, permitiendo su multiplicación, la persistencia de la mutación y la facilitación para nuevas mutaciones. Los promotores incluyen traumatismos crónicos, factores químicos, quemaduras, hormonas, infecciones, fármacos y cualquier otra causa de hiperplasiai
- c) Transformación: el DNA inestabilizado por la iniciación y ayudado por los promotores puede desencadenar la transformación. Los factores de supresión de la proliferación celular y los activadores de la apoptosisise ven desbordados o inactivados por factores de crecimiento (o sus receptores, o ambos) e inhibidores de la apoptosis descontrolados.
Por ejemplo, la proteína p53, un inductor de la apoptosis, impide la perpetuación de mutaciones en el DNA en muchos tipos celulares normales. Su ausencia o su síntesis defectuosa a consecuencia de una mutación en el gen p53 impide su entrada en el núcleo de la célula, inhibiéndose la apoptosis y facilitándose la perpetuación de DNA mutado. Un 20-40% de melanomas humanos expresan p53 y probablemente reflejan un mecanismo patogénico distinto de aquellos que no la expresan. La literatura recoge un caso de melanoma canino que no expresaba p53 [2].
En melanomas humanos se han encontrado mutaciones frecuentes en los genes INKa, INKb y Waf-1. Los dos primeros codifican las proteínas p16INKa y p15INKb, las cuales son inhibidoras de la kinasa ciclina dependiente (CDKI). La entrada en mitosis de una célula es inducida por kinasas ciclina dependientes. Por ello, las mutaciones de INKa y INKb impiden la inhibición de la mitosis y facilitan el crecimiento descontrolado. INKa también codifica la proteína p19ARF, que es un activadora de p53.
Waf-1, por su parte, codifica la proteína p21, otra CDKI, y su expresión está regulada en parte por p53. El caso descrito anteriormente carecía también de p21.
Sintetizando lo anterior, se aprecia que diferentes factores de supresión de la proliferación celular aparecen “saboteados” por mutación en muchos melanomas. [3]
La expresión del gen supresor de la apoptosis bcl-2 se ha detectado en muchos melanomas humanos, aunque este factor también se encuentra en melanocitos normales, por lo que su papel en transformaciones neoplásicas no está claro. [4]
La mutación de protooncogenes en oncogenes también favorece la proliferación tumoral. Algunos oncogenes detectados en melanomas incluyen c-myc, c-erb-B-2, c-yes, c-kit y ras.[5, 6, 7]
La progresión tumoral requiere un factor adicional: el crecimiento autónomo. Los principales factores de crecimiento autocrinos relacionados con el melanoma son el factor básico de crecimiento fibroblástico (bFGF), interleukinas (IL-8, IL-10, IL-18), el factor A de crecimiento derivado de plaquetas y la hormona estimulante a-melanocito. Los melanomas en fases avanzadas son también estimulados por factores como IL-6 y el factor-b de crecimiento tumoral. - d) Metástasis: la metástasis en sí misma también es un fenómeno que requiere varios pasos, empezando por la “desunión” de las células de la masa principal, su paso a través de endotelios, el viaje por vía sanguínea o linfática, adhesión y paso endotelial de nuevo y, finalmente, su fijación y proliferación en un nuevo tejido. Para que este complejo fenómeno tenga lugar, las células deben activar y desactivar moléculas de adhesión (cadherinas y CD44). CD44 es una proteína ampliamente expresada que parece implicada de forma consistente en el fenómeno metastático. Se trata de un glicoproteína transmembranal que funciona en la activación y extravasación de células T, en la degradación de hialuronato, agregación y migración celular, angiogénesis y hematopoyesis. La expresión atenuada de CD44 y la sobreexpresión de la variante 5 (CD44v5) ha sido descrita en melanomas metastáticos en ganglios linfáticos. [8, 9]
Las referencias de la microvascularización de melanomas y su relación con la agresividad tumoral son poco consistentes, pero parecen abonar la teoría de que la angiogénesis es crítica para la capacidad metastásica de melanomas y que se correlacionaría con un mal pronóstico. [10]
Características clínicas
Perro
Los melanomas suponen el 3% del total de neoplasias y más del 7% de los tumores malignos en el perro. [11] Las localizaciones más habituales incluyen la boca (56%), labios (23%), piel (11%), dedos (8%) y otras localizaciones (2%, incluyendo el ojo) [12].
Los melanomas de la cavidad oral se consideran prácticamente siempre malignos. Aparecen preferentemente en la encía, siendo menos frecuentes en la lengua, faringe, paladar o tonsila. Generalmente crecen rápido, son invasivos y a menudo recurren tras su extirpación quirúrgica. Entre un 70 y un 90% metastatizan [13], independientemente de su localización intraoral. El principal foco de metástasis es el ganglio linfático regional, seguido por el pulmón, pero pueden aparecer en cualquier víscera.
Los melanomas cutáneos son también relativamente frecuentes. Sin embargo, del conjunto de melanomas malignos, sólo un 10% son cutáneos, con cierta predilección por la región de la cabeza y el escroto. [14]
Los melanomas subungueales son los tumores más frecuentes en esta localización después del carcinoma de célula escamosa [15]. En esta localización pueden provocar lisis ósea en un 5% de los casos, una frecuencia mucho menor que en el caso del carcinoma de célula escamosa (80%) [15]. Marino et al. refieren evidencias radiológicas de metástasis en el 58% de los casos de melanoma subungueal, tanto antes como poco después de la cirugía, y un tiempo medio de supervivencia de 12 meses.
Los tumores melanocíticos son los más frecuentes en esta localización y aparecen principalmente el la úvea anterior [16, 17]. En su mayoría son lesiones benignas, oscilando el porcentaje de malignidad entre el 15 y cerca del 30%, con un índice de metástasis que ronda el 4% [18, 19, 20].
La incidencia del melanoma no sólo varía con la localización, sino también con la raza. Es más frecuente en razas con marcada pigmentación cutánea, como el Schnauzer o el Scottish Terrier [12]. El Setter Irlandés y el Golden Retriever presentan mayor incidencia de melanomas subungueales. El Setter Irlandés, el Chihuahua, Golden Retriever y el Cocker Spaniel presentan mayor riesgo para la localización labial [12. Finalmente, el Pastor Alemán y el Boxer muestran mayor riesgo de desarrollo de melanomas orales [21, 22].
En cuanto a la edad de presentación, aunque oscila entre 1 y 17 años, la media está en 10. Al igual que en personas, parece establecida una mayor incidencia en machos que en hembras [22].
Gato
El melanoma en el gato es infrecuente (menos del 1% de las neoplasias orales y cerca del 0,5% de las neoplasias cutáneas) [23, 24, 25]. Las localizaciones ocular y cutánea son más frecuentes que la intraoral [26, 27]. Las localizaciones cutáneas más habituales son la cabeza, la cola, la zona distal de las extremidades y la zona lumbar [26, 12, 28]. El pronóstico es con frecuencia pobre dado que la mitad de los casos muestran recurrencia y metástasis regional [12, 28, 29].
Las formas oculares de melanoma tienden a presentarse en la úvea anterior, en el iris [25, 26] . Generalmente aparecen como una hiperpigmentación difusa o focal más que como una masa o nódulo discretos [30. 31]. Los melanomas límbicos, conjuntivales o nictitantes son poco habituales [32, 33].
Los melanomas oculares felinos pueden ser localmente infiltrativos o emitir metástasis distantes [25, 34]. Algunos autores refieren crecimiento lentos, con periodos de latencia largos entre el primer diagnóstico y la presencia de metástasis, mientras que otros autores refieren metástasis tempranas [26, 30, 34].
El rango de edad de los animales afectados es de 2 a 18 años, con un pico entre los 8 y 12 años [26, 25, 28, 29]. No parece haber predilección de sexo o raza.
Aspectos Macroscópicos
Independientemente de la localización, los melanomas presentan aspectos muy variados. La coloración oscila entre el gris o marrón y negro, rojizo o azul oscuro. La pigmentación no es un rasgo característico puesto que otras lesiones neoplásicas o no neoplásicas pueden mostrar fenotipo similar. También el tamaño es variable, aunque la gran mayoría oscilan entre 1 y 3 cm. Las formas cutáneas pueden aparecer como elevaciones suaves, nódulos sésiles, pólipos, placas o masas lobuladas [35]. Los de mayor tamaño pueden mostrar ulceración superficial.
Los tumores pueden ser compresivos, pero usualmente son neoplasias no encapsuladas e infiltrativas [14].
Independientemente de la localización pueden metastatizar, principalmente en ganglios linfáticos regionales y pulmones [14]. Poseen potencial para invadir hueso y provocar lisis en dedos, maxilar, mandíbula, vértebras y costillas.
Diagnósticos Diferenciales
Clínicamente los melanomas cutáneos pueden ser confundidos principalmente con otras lesiones cutáneas pigmentadas, incluyendo tumores de célula basal, tumores foliculares (tricoblastoma, tricoepitelioma, pilomatricoma), tumores sebáceos y apocrinos.
La hiperplasia melanocítica (lentigo simplex) en labios, párpados, nariz y encía de gatos de capa anaranjada, crema o plateados, así como en abdomen y pezón en el caso del perro aparecen como máculas pigmentadas. También los hamartomas epidérmicos (nevus epidérmico pigmentado, queratosis seborreica) y los hemangiomas / hemangiosarcomas dérmicos pueden presentarse como tumores cutáneos pigmentados [36].
Aspectos Histopatológicos
El término nevus, empleado en medicina humana para describir lesiones melanocíticas, no se utiliza en veterinaria [36]. Algunos términos descriptivos utilizados en la descripción o el diagnóstico son:
1. Compuesto: indica afección simultánea de la epidermis y la dermis (epitelio y submucosa en lesiones orales).
2. Lesión en la unión (“junctional lesion”): se refiere a la localización del tumor en la interfase epidermis-dermis (epitelio-submucosa) [36].
3. Lesión “pagetoide”: indica la existencia de células sueltas o en pequeños grupos dentro de la epidermis (epitelio). El término deriva de las células de Paget (células de carcinoma infiltrantes en la epidermis, inicialmente descritas en carcinomas ductales mamarios in situ humanos.
Con independencia de su localización, los melanomas muestran una gran variabilidad histológica. Las principales formas descritas son las siguientes:
- Melanoma Epitelioide: formados por células redondeadas, de contorno citoplasmático nítido, citoplasma liso y uniforme, núcleo grande y nucleolo prominente. Puede haber o no componente “pagetoide” [35].
2. Melanoma de célula fusiforme: células organizadas en haces irregulares orientados en múltiples direcciones, entrecruzados, con núcleos grandes, nucleolos prominentes. No muestran comportamiento “pagetoide”.
3. Melanoma mixto: combina imágenes de los dos tipos anteriores.
4. Melanoma dendrítico: presenta características de célula fusiforme pero se aprecian frecuentes estructuras en espiral, compactas, a menudo con patrón de “huella dactilar”. Se presenta únicamente en la piel [36].
5. Melanoma de células claras (“balloon cell type”): descrito en la cavidad oral y piel en el perro y en la piel en el gato. Las células contienen un citoplasma finamente granular, eosinófilo muy claro con un leve fondo particulado marronáceo. El núcleo es redondo, con anisocariosisi variable, nucleolo evidente y cromatina marginada [37].
6. Melanoma con células en “anillo de sello”: documentado en la cavidad oral en gato, es también una forma amelanótica de melanoma y consta de células pleomorfas con un núcleo aplastado y excéntrico. Algunas células contienen inclusiones intracitoplasmáticas grandes y pálidas que dan nombre al tipo celular por su similitud con un anillo de sello [28].
De forma poco habitual, algunos melanomas pueden contener focos de metaplasiaicondroide u ósea [12, 36].
Criterios de Malignidad
El melanoma es una de las pocas neoplasias en las que la localización supone un indicador pronóstico. Los melanomas alojados en cavidad oral, unión mucocutánea o los melanomas subungueales se consideran malignos, con independencia de otros criterios [38]. No existe una relación evidente entre las características histológicas (incluyendo el índice mitótico o la pigmentación) y la tasa de supervivencia [39].
Para los melanomas cutáneos y oculares el parámetro más consistente en la determinación de benignidad y malignidad es el índice mitótico [20, 30, 40, 41, 42]. La presencia de tres o más mitosis por campo de 10 aumentos se considera criterio de malignidad [36]. La existencia de menos de dos mitosis por campo de 10 aumentos es indicativo de melanocitoma [42]. En gatos el valor predictivo del índice mitótico no está tan claro, especialmente en los melanomas oculares [30].
La morfología celular es otro criterio significativo [36, 40, 43]. La presencia de núcleos grandes, la variabilidad de tamaño y forma de núcleo, la hipercromasiai, la agregación cromatínica anormal, uno o más nucleolos y las figuras mitóticas atípicas son criterios de malignidad. La existencia de un patrón “pagetoide” es también indicativo de malignidad [30, 36]. La existencia o no de actividad en la unión dermo-epidérmica (epitelio-submucosa) no es significativa porque puede apreciarse tanto en melanomas como melanocitomas.
La existencia de invasión linfática o vascular es, por supuesto, un criterio evidente de malignidad [36]. En la valoración de ganglios linfáticos debe tenerse especial cuidado cuando se examinan los submandibulares. En estos ganglios no es infrecuente encontrar pigmento melánico acumulado en melanófagos procedentes de cuadros inflamatorios de la mucosa oral, imagen que puede ser confundida con la existencia de una metástasis de melanoma.
En el gato se han propuesto los siguientes criterios de malignidad para las lesiones cutáneas y orales: la atipia nuclear, la actividad mitótica y el tipo celular (se considera que las formas epitelioides presentan mayor grado de malignidad, aunque este criterio no está claramente establecido y dicha relación podría no estar tan clara). La correlación clínico-patológica de los melanomas felinos presenta aún algunas dudas serias y un diagnóstico histológico de malignidad parece que no siempre va seguido de un comportamiento maligno [29].
Por lo que respecta a los melanomas oculares, los criterios más significativos parecen ser el tipo celular (los melanomas mixtos y epitelioides presentarían mayor riesgo de metástasis) [17]. Los melanomas formados por célula fusiforme con célula pequeña y sin mitosis o por células más redondeadas con abundante pigmento melánico y núcleo redondo y pequeño son más probablemente benignos. Por el contrario, en el gato, el pleomorfismoi celular, el grado de pigmentación, la relación núcleo-citoplasma y número de nucleolos no parecen tener una relación significativa con el comportamiento metastático [44].
El tamaño, el grado de pigmentación, la intensidad de antígeno de proliferación celular (PCNA), la necrosis, la ulceración, la inflamación o la expresión de p53 son factores pronósticos de utilidad limitada en animales [41, 42, 45, 46].
Aspectos Citopatológicos
La citología de lesiones melanocíticas refleja en buena parte lo que se ha comentado en la histología, en el sentido de que se observan patrones de célula epitelioide, fusiforme o redonda [47, 48, 50, 51] .
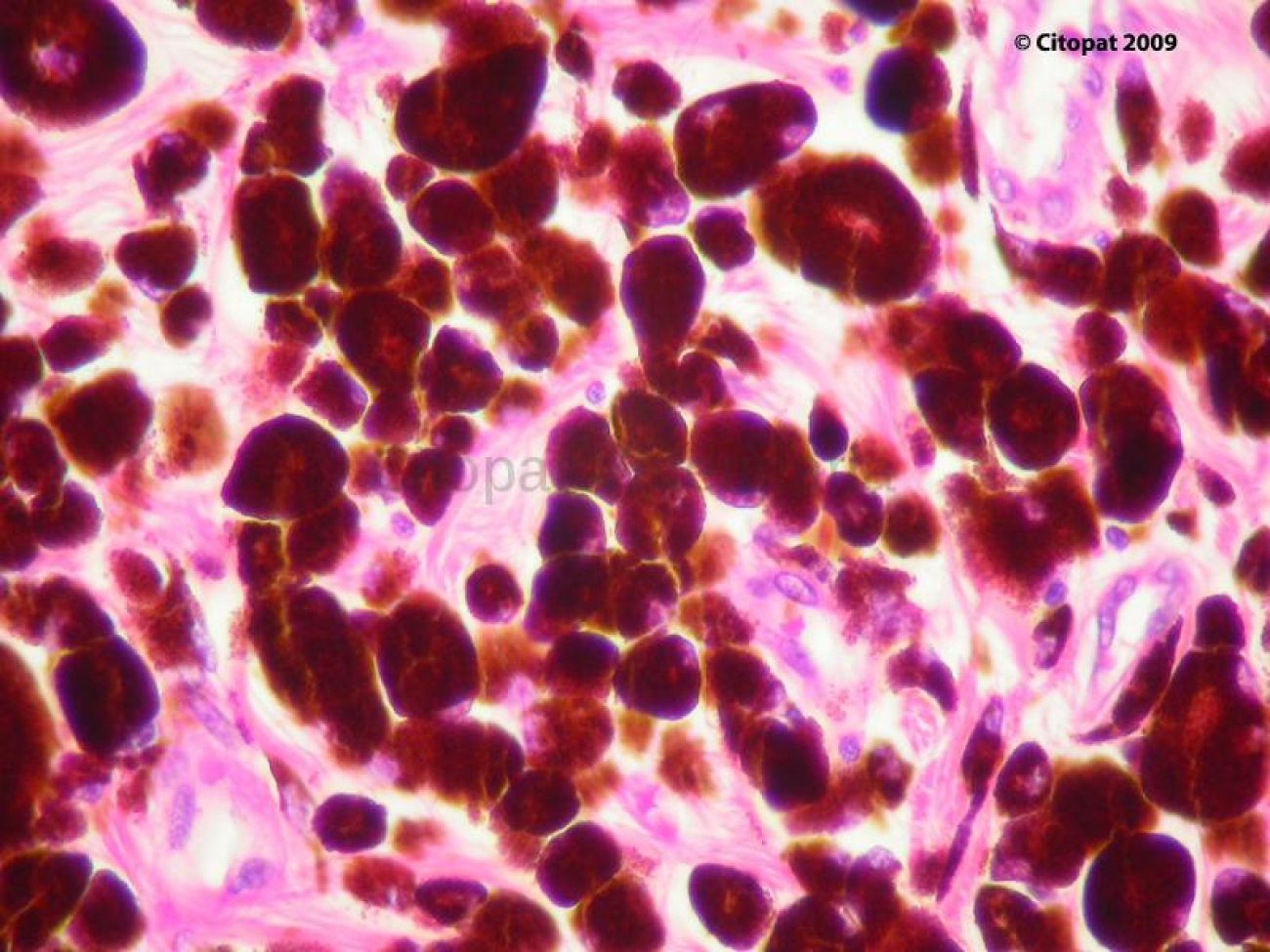
Citomorfológicamente las células poseen un núcleo central o excéntrico, redondeado u ovalado, a veces indentado, con cromatina muy fina o moderadamente densa y un nucleolo prominente redondeado, ovalado o angulado. Los nucleolos gigantes son frecuentes. Ocasionalmente se encuentran células binucleadas o multinucleadas. La relación núcleo-citoplasma suele ser moderadamente alta o muy alta. A diferencia del carcinoma de célula escamosa, el melanoma no suele inducir una fuerte reacción inflamatoria [47, 48, 49].
Las variantes de célula redonda y epitelioide contienen células de contorno redondeado, con cierta cohesividad laxa entre células en las formas epitelioides. Las formas fusiformes contienen células más “abombadas” o menos ahusadas que en otros sarcomas, o bien muestran tenues procesos citoplasmáticos. Con las tinciones rutinarias en citología el citoplasma suele mostrarse muy claro o con un fondo grisáceo oscuro o gris azulado. Los bordes citoplasmáticos pueden aparecer mal definidos, especialmente en las formas epitelioides y fusiformes. Las células pueden contener o no pigmento melánico, observable en forma de granulado negro o negro verdoso. Dicho granulado suele ser fino, puntiforme y esferulado.
La distinción entre benignidad y malignidad, como en el caso de la histología, es problemática en estos tumores. El índice mitótico no es un criterio útil en muestras citológicas. Generalmente se aplican los criterios citológicos de malignidad estándar (anisocitosisi y anisocariosis, núcleos grandes, nucleolos atípicos, etc.). En cualquier caso, las lesiones con criterios citológicos de benignidad deben ser confirmadas histológicamente.
El origen melanocítico puede ser difícil de determinar en las neoplasias amelanóticas o pobremente pigmentadas. Las variantes de célula redonda pueden imitar a lesiones histiocíticas, plasmacitomas, mastocitomas mal diferenciados y algunas formas de linfoma. Las variantes fusiformes pueden confundirse con tejido de granulación o con neoplasias mesenquimatosas en general. De entre las formas epitelioides, las que contienen pigmento pueden ser confundidas con otras lesiones epiteliales pigmentadas, y las formas amelanóticas con carcinomas en general. Es relativamente frecuente, sin embargo, especialmente en muestras bien tomadas, encontrar formas celulares de dos o incluso de los tres tipos (epitelioide, redonda y fusiforme), fenómeno no evidenciable en cualquiera de las otras neoplasias citadas. En caso de sospecha, el segundo objetivo a buscar es, obviamente, pigmentación negruzca en alguna célula.
En cualquier caso, la mayor parte del diagnóstico de melanoma recae sobre la biopsiai. La citología se emplea con más frecuencia como técnica auxiliar para el seguimiento de posibles metástasis. Aunque tenemos pocos estudios en animales relativos a la sensibilidad de la citología para la detección de metástasis, la literatura humana refleja una sensibilidad y una especificidad altas para la técnica de punción con aguja fina [52].
Inmunohistoquímica (IHQ)
La identificación de las formas amelanóticas de melanoma requiere en muchos casos el empleo de técnicas de IHQ. La mayor parte de melanomas son Vimentina positivos y Citoqueratina negativos, tanto en gato como en perro y el hombre [28, 53, 54], aunque en general todos los sarcomas presentan este patrón tintorial [53]. Muchos melanomas, además, son S100 positivos [39] (algo que también ocurre con otros tipos de neoplasia). Un cuarto marcador usado frecuentemente es la Enolasa neurono-específica (NSE), que también en este caso aparece representada en otros tejidos, especialmente de origen neural o neuroendocrino [39].
Uno de los marcadores más específicos hoy por hoy para melanomas es el antígeno Melan-A. Melan-A es una proteína de función desconocida que induce una respuesta de célula T citotóxica. Su distribución es bastante amplia y la inmunotinción para esta proteína suele ser muy alta en el citoplasma de células melanocíticas. En el trabajo de Ramos-Vara [39], con 129 casos de melanoma, el 92% expresaban Melan-A, el 100% Vimentina, el 98% S-100 y el 89,1% NSE. Un trabajo más reciente [55], sin embargo, muestra una positividad alta de Melan-A en melanomas pigmentados (90%), pero nula en 10 melanomas amelanóticos. Los resultados parcialmente contradictorios obligan a esperar nuevos trabajos que objetiven la utilidad de este marcador. En cualquier caso, el empleo de varios marcadores simultáneos sobre el mismo tumor permiten obtener un grado de fiabilidad bastante alto.
A mediados de los ochenta surgieron anticuerpos específicos para antígenos asociados a melanoma (principalmente melanosomas, conocidos como “human melanosome-specific antigens” o HMSA 1 y 5). Dichos anticuerpos reaccionan con el 60 y el 69% de los melanomas caninos, y el porcentaje aumenta hasta un 83% si se usan en combinación [56].
Existe otro anticuerpo monoclonal, el HMB-45 que ha mostrado ser sensible en ciertos subtipos de melanoma humano, pero en general parece ser de utilidad muy limitada en animales [56].
El primer anticuerpo monoclonal especialmente diseñado para reconocer melanomas de origen animal es IBF9, con una sensibilidad superior al 80% [57]. Aunque reacciona de forma cruzada con otros tipos de neoplasia (tumores de célula basal, linfomas), la distinción no es difícil mediante el empleo de otros marcadores.
Comentarios: